
CASO 119
13 de diciembre
Dr. Reinhard Rodríguez y Dra. Vanessa García Valencia. Residentes Dermatopatología, Universidad CES. Dra. Camila Montoya. Patóloga- Dermatopatóloga. MSPBS. Asunción, Paraguay.
Hombre, 30 años, múltiples pápulas asintomáticas, color piel, de 0,4 cc en el pecho. Sin antecedentes familiares.
¿Cuál cree usted es el diagnóstico más probable?
A. Esteatocistoma múltiple
B. Nevus del folículo piloso
C. Siringomas
D. Quiste velloso eruptivo
Solución y cierre del caso 23 de diciembre
CASO 112 (1ra y 2da parte)
3 de Mayo
Dra. Camila Montoya. Patóloga-Dermatopatóloga. Asunción, Paraguay. Dr. Rodrigo Restrepo. Patólogo-Dermatopatólogo. Profesor Programa de Especialización en Dermatopatología. Universidad CES. Medellín, Colombia.
Caso cortesía Dra. Ana María Aristizabal. Dermatológa. Profesora Univerdidad CES, Mdlln, Colombia.
Niña, 13 años. Áreas alopécicas fronto temporo parietales. Se tomaron dos grupos de biopsias en momentos diferentes (F1 primero; F2, F3 y F4 meses después)
Con los hallazgos histológicos ¿cuál cree es el diagnóstico más probable?
A. Alopecia androgénica
B. Alopecia frontal fibrosante
C. Alopecia areata en patrón ofiásico
D. Alopecia por tracción
Fotos clínicas 8 de mayo
Solución y cierre del caso 18 de mayo
 F1 |  F2 |  F3 |
|---|---|---|
 F4 |  F5 |
CASO 120
18 de enero
Dr. Reinhard Rodríguez y Dr. Javier Hernández. Residentes Dermatopatología, Universidad CES. Dra. Camila Montoya. Patóloga- Dermatopatóloga. MSPBS. Asunción, Paraguay.
Caso y fotos clínicas cortesía Dra. Carolina Velásquez. Profesora Dermatología Universidad CES. Mdlln, Col
Paciente masculino de 85 años quien presenta mácula hiperpigmentada en la frente.
¿Cuál cree usted es el diagnóstico más probable?
A. Queratosis actínica pigmentada
B. Lentigo solar
C. Nevus displásico
D. Lentigo maligno
Solución y cierre del caso 30 de enero
CASO 119
13 de diciembre
Dr. Reinhard Rodríguez y Dra. Vanessa García Valencia. Residentes Dermatopatología, Universidad CES. Dra. Camila Montoya. Patóloga- Dermatopatóloga. MSPBS. Asunción, Paraguay.
Hombre, 30 años, múltiples pápulas asintomáticas, color piel, de 0,4 cc en el pecho. Sin antecedentes familiares.
¿Cuál cree usted es el diagnóstico más probable?
A. Esteatocistoma múltiple
B. Nevus del folículo piloso
C. Siringomas
D. Quiste velloso eruptivo
Solución y cierre del caso 23 de diciembre
Si no te has inscrito, para opinar debes unirte a nuestra lista de correo AQUí
ESTACIÓN PIEL
Programa de Especialización en Dermatopatología
Universidad CES
Casos 2020
segunda parte
CASO 118
15 de noviembre (1era parte)
Dr. Reinhard Rodríguez y Dra. Vanessa García Valencia. Residentes Dermatopatología, Universidad CES. Dra. Juanita Arango Abissad. Residente III de dermatología. Universidad CES. Mdlln, Col. Dra. Camila Montoya. Patóloga-Dermatopatóloga. MSPBS. Asunción, Paraguay.
Caso cortesía Dra. Tatiana González – Dra. Natalia Vélez . Profesoras Programa de Dermatología, Universidad CES. Mdlln, Col.
Hombre 39 años. Lesión pigmentada en espalda que ha evolucionado en el transcurso de 1 año. Ver dermatoscopias (F1-F2).
Con los datos clínicos, dermatoscópicos e histológicos (HE) suministrados ¿Cuál cree usted es el diagnóstico más probable?
A. Lentigo solar
B. Halo nevus
C. Melanoma invasor con regresión
D. Queratosis liquenoide benigna
Inmunohistoquímica 22 noviembre
Solución y cierre del caso 30 de noviembre


















Respuestas 15 XI 2020 (1ra parte: Clínica y HE)
Halo nevus Joseph Arzapalo
Q. L. benigna Juan Carlos Jaimes Ramírez
M. invasor Carlos Saldaña Rivas
Halo nevus Lizza Paz
Halo nevus Sonia Tello
M. invasor Isabel Restrepo
Halo nevus Melissa Alejandra Quintero P.
M. invasor Soledad Machado
M. invasor Karol Baksai Elespuru
Q. L. benigna Juan Felipe Pinilla Hurtado
Halo nevus Pablo Uribe González
M. invasor Elizabeth Milena Arciniegas
Halo nevus Fernando Cabo Gómez
Q. L. benigna Jesús Cuevas Santos
Q. L. benigna Beatriz Di Martino
Halo nevus Marcia Kibune
Halo nevus Julia Inés Mesa
Halo nevus Elizabeth Ball de Picón
Halo nevus Elena Gallego Domínguez
Halo nevus Javier Ricardo Hernández M.
Halo nevus Gonzalo Eguiguren Lira
Halo nevus Enrique Bellolio
M. invasor Gerardo Prada Ch.
Respuestas 22 XI 2020 (2da parte: Clínica, HE, e IHQ)
Halo nevus Karol Baksai Elespuru
M. invasor Elizabeth Milena Arciniegas
Halo nevus Juan Eduardo Aguirre
Halo nevus Jesús Cuevas Santos
Halo nevus Mary Escarabay
Halo nevus Paula Difilippo
Halo nevus Enoi Villar
Halo nevus Julia Inés Mesa
M. invasor Jaime Campuzano
Halo nevus Miguel Borje
Halo nevus Alejandro pineda
Halo nevus Carlos Barria
Halo nevus Esther Mariela Estrada
Q. L. benigna Carmen Camauta
M. invasor Joseph Arzapalo
Halo nevus Marcia Kibune
Q. L. benigna María Elizabeth Rodríguez P.
Halo nevus María del Consuelo Gómez Y
Respuesta
B. Halo nevus (HN)
Descrito por Sutton en 1916, refiriéndose a un borde o anillo claro alrededor de una lesión cutánea, con predominancia en lesiones melanocíticas. La aparición del halo se correlaciona con el inicio de la regresión de la lesión y finalmente puede conducir a su desaparición completa, dejando una mácula hipopigmentada que con el tiempo puede repigmentarse (1).
El halo nevus se presenta frecuentemente en niños y adultos jóvenes sin distinción de raza o sexo, descrita como una lesión solitaria con localización en tronco y espalda; incluso algunos casos han sido descritos en nevus congénitos. La presentación de lesiones múltiples sugiere mayor riesgo de enfermedades autoinmunes, así como su asociación con vitíligo. El color más frecuente del halo nevus es blanco, sin embargo, existen otros colores como halo rojo con vasos centrales telangiectásicos (2).
La etiología de esta entidad aún es desconocida. Se sabe que existe un aumento en el nivel de quimioquinas CXCL10-CR3 inducidos por IFN-γ, que asociados con el estrés oxidativo contribuyen a la apoptosis y el reclutamiento de linfocitos T CD8+ que contribuyen con la destrucción de melanocitos en el halo nevus (5). Las características clínicas y dermatoscópicas permiten distinguir entre el fenómeno de halo en distintas entidades como nevus melanocíticos benignos, melanomas en regresión y melanocitosis tumoral. (6).
La relación entre el fenómeno de halo nevus y melanoma siempre ha sido un tema de interés. Actualmente se ha sugerido, con limitada evidencia, que la aparición de un halo nevus aumenta el riesgo de melanoma, ya sea en el centro del halo nevus o en otros sitios cutáneos o extracutáneos (4). La presencia de este fenómeno pudiera sugerir una respuesta inflamatoria eficaz contra antígenos melanocíticos que puede ser explotada con inmunoterapia. Sin embargo, las series de casos fallan en demostrar una diferencia real en el pronóstico para aquellos melanomas asociados a halo, en parte debido a la subestimación del nivel de Breslow oscurecido por el proceso inflamatorio (7).
A la dermatoscopia se suele identificar un patrón globular con gránulos de pigmento disperso entremezclado con áreas blancas o en forma globular homogénea y menos frecuente la presencia del patrón en red de pigmento (F1-F2). En ocasiones el componente central del halo nevus, desaparece y deja pigmentación rojiza asociada a vasos telangiectásicos (3).
Histológicamente, se observa piel con presencia de una lesión melanocítica benigna a nivel de la unión dermoepidérmica e intradérmica, acompañada de infiltrado inflamatorio linfohistiocitario difuso que destruye células névicas y dejan restos de pigmento melánico en el proceso inflamatorio, todo en ausencia fibroplasia lamelar. No se reconocen criterios de sospecha como asimetría de la lesión, diseminación pagetoide ni atipia significativa (F3-F10).
Por inmunohistoquímica el infiltrado inflamatorio muestra una población heterogénea entre linfocitos T y B, con predominio para linfocitos T CD4 y CD8+ (F14-F16). Las tinciones con Melan A y SOX10 resaltan los nidos melanocíticos con adecuada simetría y sin evidencia de diseminación pagetoide, entremezclados con el proceso inflamatorio (F11-F12). La tinción con HMB45 en este caso presenta un patrón en degradado, asociado a lesiones benignas (F13). Sin embargo, se describen casos con patrones de tinción aberrantes (positividad intensa, positividad aleatoria, negativos) los cuales pueden hacer necesario el diagnóstico diferencial con melanomas en regresión. En estos casos, los demás criterios clínicos e histológicos permiten distinguir entre estas dos entidades (8). P16 fue positivo y prame negativo (F18, F19). La tinción con p40 resalta queratinocitos basales, sin evidencia de alteración de la unión dermoepidérmica (F17)
A. Lentigo solar: Si bien los lentigos solares pueden presentar fenómeno de halo, la histología permite distinguirlo por la ausencia de nidos melanocíticos.
C. Melanoma invasor con regresión: Dermatoscópicamente la ausencia de telangiectasias, patrón velado o diversas tonal en la lesión melanocítica orienta hacia un comportamiento benigno. Microscópicamente, no se reconoce diseminación pagetoide, patrón confluente individual a nivel del estrato basal, ni patrón infiltrativo estromal. Estos criterios se demuestran con la marcación de inmunohistoquímica.
D. Queratosis liquenoide benigna: Quizá el diagnóstico diferencial más difícil. Se debe revisar minuciosamente el infiltrado inflamatorio denso en cualquier lesión en regresión con el fin de identificar la lesión de origen. En este caso, la demostración de nidos de células névicas y la ausencia de cambios epidérmicos como acantosis, hipergranulosis y daño de interfase vacuolar con cuerpos apoptóticos permiten distinguir entre estas entidades. En caso de dudas, se recomienda complementar con inmunohistoquímica.
Artículo completo en:
Vanessa García Valencia,, Reinhard Rodríguez Schotborgh, Juanita Arango Abisaad, Juan Eduardo Rocha Aguirre, Tatiana González Álvarez, Harvey Andrés Flórez Posada. Halo nevus vs. melanoma en regresión, perspectiva dermatoscópica, histopatológica e inmunohistoquímica. 2021. Piel
Bibliografía:
-
Aouthmany M, Weinstein M, Zirwas MJ, et al. The natural history of halo nevi: a retrospective case series. J Am Acad Dermatol. 2012 Oct;67(4):582-6. Pub Med
-
Kamińska-Winciorek G, Szymszal J. Dermoscopy of halo nevus in own observation. Postepy Dermatol Alergol. 2014;31(3):152-158. Free text link
-
Schwartz RJ, Vera K, Navarrete N, et al. In vivo reflectance confocal microscopy of halo nevus. J Cutan Med Surg 2013; 17: 33-8. Pub Med:
-
Haynes D, Strunck JL, Said J, et al. Association Between Halo Nevi and Melanoma in Adults: A Multi-Center Retrospective Case Series. J Am Acad Dermatol. 2020 Aug 18: S0190-9622(20)32449-X. Pub Med
-
Yang Y, Li S, Zhu G, Zhang Q, et al. A similar local immune and oxidative stress phenotype in vitiligo and halo nevus. J Dermatol Sci. 2017 Jul;87(1):50-59. Pub Med
-
George EV, Kalen JE, Kapil JP, et al. Comparison of the Inflammatory Infiltrates in Tumoral Melanosis, Regressing Nevi, and Regressing Melanoma. Am J Dermatopathol. 2019 Jul;41(7):480-487. Pub Med
-
Tas F, Erturk K. Presence of histological regression as a prognostic factor in cutaneous melanoma patients. Melanoma Res. 2016 Oct;26(5):492-6. doi: 10.1097/CMR.0000000000000277. PMID: 27380112. Pub Med
-
Ruby, K.N., Li, Z. and Yan, S. (2020), Aberrant expression of HMB45 and negative PRAME expression in Halo Nevi. J Cutan Pathol. Accepted Author Manuscript. https://doi.org/10.1111/cup.13916 Pub Med
CASO 119
13 de diciembre
Dr. Reinhard Rodríguez y Dra. Vanessa García Valencia. Residentes Dermatopatología, Universidad CES. Dra. Camila Montoya. Patóloga- Dermatopatóloga. MSPBS. Asunción, Paraguay.
Hombre, 30 años, múltiples pápulas asintomáticas, color piel, de 0,4 cc en el pecho. Sin antecedentes familiares.
¿Cuál cree usted es el diagnóstico más probable?
A. Esteatocistoma múltiple
B. Nevus del folículo piloso
C. Siringomas
D. Quiste velloso eruptivo
Solución y cierre del caso 23 de diciembre
 F1 |  F2 |  F3 |
|---|---|---|
 F4 |  F5 |
Respuestas 23 XII 2020
Quiste velloso eruptivo Sonia Tello
Quiste velloso eruptivo Mónica Gaviria
Quiste velloso eruptivo Javier Ricardo Hernández M.
Quiste velloso eruptivo Griselda de Anda
Quiste velloso eruptivo Juan Eduardo Rocha A.
Quiste velloso eruptivo Guimar Jiménez
Quiste velloso eruptivo María Gloria Mendoza de S.
Quiste velloso eruptivo Luciana Battipiede
Quiste velloso eruptivo Margarita Torres Cruz
Quiste velloso eruptivo Karol Baksai Elespuru
Quiste velloso eruptivo Verónica Posso
Quiste velloso eruptivo Gerardo Prada
Quiste velloso eruptivo Beatriz di Martino
Quiste velloso eruptivo Rolando Hernández Pérez
Quiste velloso eruptivo Mary Escarabay
Quiste velloso eruptivo Mayra Carrijo-Rochael
Quiste velloso eruptivo Heliana Botello
Quiste velloso eruptivo Magda Jimena Vargas
Quiste velloso eruptivo Ramiro Pinedo
Quiste velloso eruptivo María Fernanda Tibaduiza
Quiste velloso eruptivo Libia Jiménez
Quiste velloso eruptivo Alicia Benavides
Quiste velloso eruptivo Bertha Julieth Garzón M.
Quiste velloso eruptivo Esther Mariela Estrada
Quiste velloso eruptivo Enrique Bellolio
Quiste velloso eruptivo Gonzalo Eguiguren
Quiste velloso eruptivo Fredy Salazar
Quiste velloso eruptivo Mónica Ruiz Ballón
Quiste velloso eruptivo Liliana de Gracia
Quiste velloso eruptivo Elizabeth Milena Arciniegas
Quiste velloso eruptivo María del Consuelo Gómez Y.
Quiste velloso eruptivo Elizabeth Ball de Picón
Quiste velloso eruptivo María del Mar Lorido
Quiste velloso eruptivo Marcia Hamada
Quiste velloso eruptivo Víctor León
Quiste velloso eruptivo Juan Camilo Barrera Gamboa
Quiste velloso eruptivo Víctor Otero
Respuesta
D. Quiste velloso eruptivo (QVE)
El diagnóstico histopatológico es sencillo. El QVE (Esterly y cols. 1977) corresponde a una lesión quística benigna poco común. Algunos lo consideran un tipo de hamartoma que se diferencia hacia el vello, mientras otros plantean como etiología la oclusión infundibular con retención del pelo y posterior dilatación (1, 2).
Su incidencia es desconocida debido a la dificultad en distinguirlo clínicamente de los quistes infundibulares y esteatocistomas (3). Es frecuente en niños, adolescentes o adultos jóvenes, la mayor parte de forma esporádica, sin predilección por sexo o raza. Rara vez se ha asociado con insuficiencia renal, paquioniquia congénita, displasia ectodérmica anhidrótica e hidrótica y el síndrome de Lowe.
Clínicamente son múltiples pápulas de color amarillento o pardo claro. En ocasiones puede presentar una costra hiperqueratósica central y umbilicada. Las lesiones están localizadas principalmente en tórax, extremidades, región facial e inguinal. (3)
Histológicamente es una lesión quística dérmica (F1), tapizada por epitelio similar a la porción infundibular o del istmo del folículo piloso. El epitelio de revestimiento presenta tres capas de células escamosas, con estrato granular delgado y queratinización compacta (F2-F3). El interior del quiste contiene queratina lamelar condensada y múltiples vellos (F4-F5). Ocasionalmente la pared quística puede estar en continuidad con un folículo piloso rudimentario o con el músculo piloerector (4).
A. Esteatocistomas múltiples: Es el principal diagnóstico diferencial. Corresponde a un síndrome hereditario asociado a la mutación de gen que codifica la queratina 17. Se caracteriza por quistes de paredes delgadas tapizadas por epitelio escamoso estratificado con ribete ondulado similar al ducto sebáceo, sin capa granulosa y con presencia de glándulas sebáceas rudimentarias adosadas a la pared.
Debido a su origen en la unidad pilosebácea, se ha considerado a estas dos entidades como parte de un mismo espectro. Hay casos donde se observen ambos tipos de lesión o lesiones con características híbridas. La inmunohistoquímica ha demostrado ser de utilidad. Los QVE resultan positivos solo para CK17, a diferencia de los esteatocistomas que son positivos para CK10/CK17 (4).
B. Nevus del folículo piloso: Ver Caso 58.
C. Siringomas: Ver Caso 33
Bibliografía
-
Esterly NB, Fretzin DF, Pinkus H. Eruptive vellus hair cysts. Arch Dermatol 1977;113:5003. Pub Med
-
Khatu S, Vasani R, Amin S. Eruptive vellus hair cyst presenting as asymptomatic follicular papules on extremities. Indian Dermatol Online J. 2013 Jul;4(3):213-5. Free Text Link
-
Torchia D, Vega J, Schachner LA. Eruptive vellus hair cysts: a systematic review. Am J Clin Dermatol. 2012 Feb 1;13(1):19-28. Free Text Link
-
Anand P, Sarin N, Misri R, Khurana VK. Eruptive Vellus Hair Cyst: An Uncommon and Underdiagnosed Entity. Int J Trichology. 2018 Jan-Feb;10(1):31-33. Free Text Link
CASO 117
15 de Octubre
Dr. Reinhard Rodríguez. Residente Dermatopatología. Dra. Vanessa García Valencia. Residentes Dermatopatología, Universidad CES. Mdlln, Col.
Dra. Camila Montoya. Patóloga-Dermatopatóloga. MSPBS. Asunción, Paraguay.
Caso cortesía Dr. Víctor Otero M. MD Dermatólogo UNAM, México. Docente de Médicina en la Universidad del Sinú. Dermatólogo, Montería, Col.
Hombre 35 años. Lesión alopécica en vertex cuero cabelludo.
Con los datos clínicos e histológicos suministrados ¿Cuál cree usted es el diagnóstico más probable?
a. Alopecia sifilítica
b. Liquen plano pilar
c. Alopecia cicatricial central centrifuga
d. Lupus eritematoso discoide
Solución y cierre del caso el 31 de octubre
 |  F1 |  F2 |
|---|---|---|
 F3 |  F4 |  F5 |
Respuestas
Al. cicatricial central centrifuga Vanessa García
Alopecia sifilítica Nancy Grandez
Liquen plano pilar Marcia Kibune
Lupus eritematoso discoide Jaime Campuzano
Liquen plano pilar Anónimo
Al. cicatricial central centrifuga Anónimo
Al. cicatricial central centrifuga Jesús Cuevas Santos
Alopecia sifilítica Camilo Alarcón Pérez
Al. cicatricial central centrifuga Esther Mariela Estrada
Al. cicatricial central centrifuga Anónimo
Al. cicatricial central centrifuga Juan Eduardo Rocha A.
Googles
Al. cicatricial central centrifuga Isabel Restrepo
Liquen plano pilar Elizabeth Ball de Picón
Liquen plano pilar Anónimo
Liquen plano pilar María del Consuelo Gómez
Al. cicatricial central centrifuga Ruth Aybar Cancho
Respuesta
C. Alopecia cicatricial central centrífuga (ACCC).
Descrita inicialmente en 1968 por LoPresti y cols. como una variante de alopecia cicatricial de predominio en vértex, observada en mujeres afrodescendientes con historia de tratamientos para alisado capilar 1,2. Sin embargo, se han descrito casos de ACCC en pacientes sin asociación con el uso de tratamiento de alisado capilar, pacientes masculinos, niños, e incluso pacientes caucásicos; lo cual revela que existen componentes en la fisiopatología fuera de los mecanismos de daño folicular extrínseco que modifican el curso clínico y explican presentaciones inusuales, como en este caso 3.
Actualmente, se considera que la ACCC presenta una etiología multifactorial. Si bien el mecanismo de daño folicular sine qua non corresponde a la descamación prematura de la vaina radicular interna, las causas de este fenómeno aún son desconocidas.
Nuevas investigaciones revelan que el estado profibrótico del paciente, relacionado con la frecuencia de formación de queloides, leiomiomas uterinos, aterosclerosis y esclerosis sistémica; contribuye a la cicatrización exagerada al daño folicular. Este fenómeno se encuentra acentuado en los afrodescendientes debido a ciertos alelos autosómicos dominantes. Se plantean, además, ciertas alteraciones genéticas como daño en el gen PADI3, el cual se relaciona con el síndrome de pelo impeinable. Esta última entidad comparte con la ACCC el mecanismo de daño prematuro de la vaina radicular interna.
Finalmente, ciertos factores ambientales como medicamentos, cosméticos, productos químicos y las prácticas de cuidado del cabello contribuyen a la enfermedad como detonantes o agravantes 4.
Histológicamente, la ACCC se clasifica como una alopecia cicatricial con infiltrado de predominio linfocítico. Por lo tanto, se debe distinguir de otras entidades como lo son el liquen plano pilar y el lupus eritematoso discoide.
Esta entidad se prefiere evaluar en cortes horizontales de cuero cabelludo ya que se pueden observar cambios focales característicos y ofrece información sobre el grado de compromiso de la entidad. Sin embargo, se puede realizar el diagnóstico con relativa facilidad con ambos tipos de corte 5,6.
La ACCC se caracteriza por un patrón de alopecia cicatricial que se relaciona con una disminución del conteo folicular asociado a pérdida de las glándulas y la presencia de fusión de folículos que se reconocen formando un patrón de gafas de buceo o de cara de mono (F1). Con mayor detalle observamos que el infiltrado inflamatorio es de predominio linfocítico, el cual se sitúa por fuera de la banda de fibrosis lamelar perifolicular, la cual presenta colágeno claro y edematoso. No se observan daño de interfase o la presencia de cuerpos apoptóticos (F2-3). Además, se identifica descamación extensa de la vaina radicular interna, presencia de tallos foliculares asimétricos con disposición excéntrica (F4) tallos pilosos desnudos a nivel de los tractos fibrosos rodeados por inflamación granulomatosa (F5) 7.
B. Liquen plano pilar (LPP): Es el diagnóstico diferencial más difícil si se tiene en cuenta solo las características histológicas. La clave se encuentra en la ausencia de daño de interfase a nivel de la vaina radicular externa y la ausencia de cuerpos apoptóticos. Otros hallazgos que favorecen ACCC sobre LPP son: la presencia de glándulas sebáceas que rodeen a un folículo piloso en telógeno, la hiperqueratosis folicular en el infundíbulo, la fibrosis observada que suele ser más edematosa, y la presencia de tallos pilosos excéntricos y asimétricos. Ver caso 57
D. Lupus eritematoso discoide (LED): La evaluación de la epidermis interfolicular es de gran ayuda para realizar este diagnóstico diferencial. En el LED se aprecia un compromiso de interfase vacuolar. Se asocia con denso infiltrado linfocítico perifolicular, perivascular y periecrino, además de taponamiento folicular y depósito de mucina en la dermis reticular. A diferencia de la ACCC, no se observa fibrosis perifolicular concéntrica, fusión de folículos pilosos a nivel infundibular ni tallos pilosos asimétricos o excéntricos. Ver caso caso 15
A. Alopecia sifilítica: Esta entidad pertenece a las alopecias no cicatriciales. Por lo tanto, los cambios relacionados con la fibrosis perifolicular y la fusión de folículos pilosos se encuentran ausentes en esta entidad. La realización de pruebas serológicas y la correlación clínica pueden ayudar en el diagnóstico diferencial.
Bibliografía:
-
LoPresti P. Hot comb alopecia. Arch Dermatol. 1968;98(3):234. PubMed
-
Herskovitz I, Miteva M. Central centrifugal cicatricial alopecia: challenges and solutions. Clin Cosmet Investig Dermatol. 2016 Aug 17;9:175-81. FreeText
-
Ogunleye TA, McMichael A, Olsen EA. Central centrifugal cicatricial alopecia: what has been achieved, current clues for future research. Dermatol Clin. 2014 Apr;32(2):173-81. PubMed
-
Aguh C. Updates in our understanding of central centrifugal cicatricial alopecia. Cutis. 2019 Dec;104(6):316;340. Free text
-
Dlova NC, Salkey KS, Callender VD, McMichael AJ. Central Centrifugal Cicatricial Alopecia: New Insights and a Call for Action. J Investig Dermatol Symp Proc. 2017 Oct;18(2):S54-S56. PubMed
-
Miteva M, Tosti A. Pathologic diagnosis of central centrifugal cicatricial alopecia on horizontal sections. Am J Dermatopathol. 2014 Nov;36(11):859-64; quiz 865-7. Pubmed
-
Stefanato CM. Histopathology of alopecia: a clinicopathological approach to diagnosis. Histopathology. 2010 Jan;56(1):24-38. Free text
CASO 116
16 de Septiembre
Dr. Reinhard Rodríguez. Residente Dermatopatología, Universidad CES. Mdlln. Col. Dra. Camila Montoya. Patóloga-Dermatopatóloga. MSPBS. Asncn, Pargy. Dr. Rodrigo Restrepo. Patólogo-Dermatopatólogo. Profesor Programa de Especialización en Dermatopatología. Universidad CES. Mdlln. Col.
Caso cortesía Dr. Angela Londoño. Jefe Programa de Dermatología Universidad CES. Mdlln. Col.
Mujer, 31 años. Dos años de placas alopécicas en vertex de cuero cabelludo, blandas. Aparición de nuevas lesiones en los últimos meses. No antecedentes de importancia.
Con los datos clínicos e histológicos suministrados ¿Cuál cree usted es el diagnóstico más probable?
A. Pseudopelada de Brocq
B. Metástasis
C. Hemangioma epitelioide
D. Nódulos alopécicos y asépticos del cuero cabelludo
Solución y cierre del caso el 4 de octubre
 F1 |  F2 |  F3 |
|---|---|---|
 F4 |  F5 |  F6 |
 F7 |  F8 |  F9 |
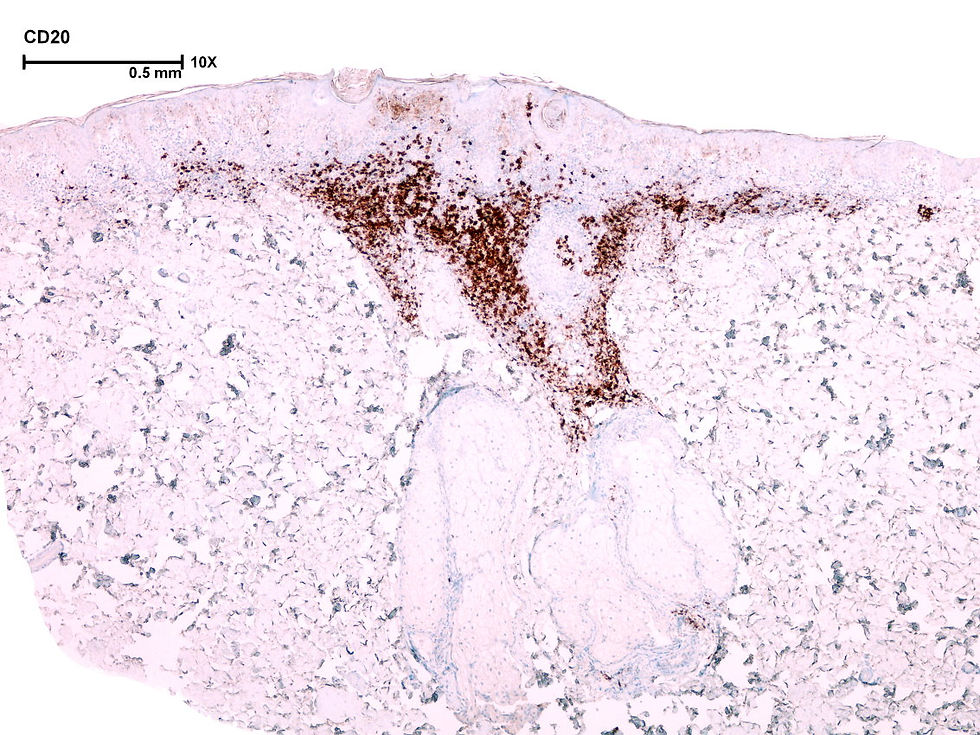
 F10 CD34 |  F11 CD3 / CD20 |  F12 CD3 / CD20 |
Respuestas
Hemangioma epitelioide Vanessa García
Pseudopelada de Brocq Lizza Paz
Hemangioma epitelioide Isabel Colmenero
Pseudopelada de Brocq Marisol Ibar Madarriaga
Hemangioma epitelioide Sonia Tello
Nód. Alop y Asépt. del CC Alejandra Toro
Hemangioma epitelioide Gonzalo Eguiguren
Hemangioma epitelioide Fernando Cabo Gómez
Hemangioma epitelioide Guillermo Ramos
Hemangioma epitelioide Anónimo
Hemangioma epitelioide María Janeth Vargas
Nód. Alop y Asépt. del CC Guimar Jiménez
Hemangioma epitelioide Beatriz di Martino
Hemangioma epitelioide Natalia Rodríguez
Pseudopelada de Brocq Melissa Quintero
Hemangioma epitelioide Bertha Yulieth Garzón Mora
Hemangioma epitelioide Jeanneth Echeverry Villegas
Hemangioma epitelioide Marco Alfonso Nieto García
Nód. Alop y Asépt. del CC Elizabeth Milena Arciniegas
Hemangioma epitelioide Julia Mesa
Hemangioma epitelioide Esther Mariela Estrada
Pseudopelada de Brocq Francisco Javier Merino
Hemangioma epitelioide Carlos Saldaña
Respuesta
C. Hemangioma epitelioide (HE)
Descrito como hiperplasia angiolinfoide con eosinofilia por Wells y Whimster en 1969 (1), fue considerado erróneamente como una variante tardía de la enfermedad de Kimura (2). Weiss y Enzinger introdujeron el término hemangioma epitelioide en 1982 (3).
El HE del tipo presente en este caso predomina en individuos jóvenes, al parecer ligeramente más en mujeres, sin predilección racial. Se manifiesta como pápulas o nódulos (F1-F2), generalmente poco sintomáticos, que cuando son múltiples tienden a agruparse en las orejas, frente, cuero cabelludo y cuello, aunque se ha descrito con menos frecuencia en otras localizaciones. Usualmente no hay otra enfermedad asociada. Los exámenes de laboratorio pueden mostrar, en un pequeño porcentaje de pacientes, ligera eosinofilia. Su etiología es desconocida, sin embargo, se ha relacionado con eventos a traumáticos y fenómenos de cortocircuito arteriovenoso congénitos o adquiridos. (4, 5).
Histológicamente, el HE cutáneo es típicamente un proceso intradérmico o subcutáneo, aunque puede originarse en tejidos más profundos, incluyendo tejido óseo, pudiendo ser en este último sitio de tipo multicéntrico y con mayor celularidad y atipismo. El HE cutáneo del tipo hiperplasia angiolinfoide con eosinofilia mostrado aquí, se caracteriza por una proliferación lobulada de canales vasculares, rodeadas por un estroma fibromixoide (F3-F5), con células endoteliales de amplio citoplasma eosinófilo (F6, F8), algunas vacuoladas (F6), las cuales protruyen hacia la luz dando un aspecto empedrado (F7). El componente inflamatorio acompañante es notorio, caracterizado por un infiltrado linfoide reactivo (F3, F4) con histiocitos, plasmocitos y frecuentes agregados linfoides (F3, F9). Hay abundantes eosinófilos (F5 – F8) (5). La inmunohistoquímica para CD34 resalta el endotelio empedrado (F10), así como el infiltrado linfoide reactivo con CD20 positivo para linfocitos B foliculares y CD3 para linfocitos T interfoliculares (F11, F12). Puede haber fibrosis en los estadios tardíos, con menos hiperplasia endotelial e infiltrado inflamatorio. Es peculiar de la forma subcutánea del HE la proliferación más florida de grandes células endoteliales epitelioides que pueden volverse muy exuberantes y formar sólidos nódulos o racimos intraluminales. Por el contrario, el HE dérmico tiende a ser más pequeño y compuesto por vasos abiertos más maduros revestidos por células endoteliales menos epitelioides (5, 6, 7).
Aunque el HE cutáneo no involuciona espontáneamente, presenta en general un curso indolente, siendo la resección quirúrgica el tratamiento de elección. Sin embargo, puede recurrir hasta en un tercio de los casos después de una escisión quirúrgica incompleta (4). No se han reportado metástasis a distancia.
A un nivel más general, el HE se ha subclasificado en tres subtipos basados en la morfología (8): (1) el subtipo "convencional", que no tiene infiltrados inflamatorios prominentes o mayor celularidad; (2) el subtipo de “hiperplasia angiolinfoide con eosinofilia” contiene un infiltrado inflamatorio que incluye folículos linfoides y eosinófilos, como en este caso y (3) el subtipo "celular", que exhibe un crecimiento en forma de láminas de células tumorales superior al 50%.
La mayor parte de la HE con reordenamiento del FOS se detectan en el hueso y tejidos blando (6), mientras que los HE cutáneos, con características de hiperplasia linfoide con eosinofilia son negativos. Sin embargo, existe una variación significativa en la sensibilidad informada de FOSB en la inmunohistoquímica. FOSB es 75% sensible para el subtipo convencional, 100% sensible para el subtipo hiperplasia angiolinfoide con eosinofilia, pero sólo 10% sensible para el subtipo celular, que como se mencionó anteriormente alberga reordenamientos del gen FOS en muchos de los casos (9).
Estos estudios destacan la necesidad de examinar más a fondo si el hemangioma epitelioide pudiera abarcar entidades genéticas y clínicamente distintas.
A pesar de la heterogeneidad genética antes mencionada, la tinción nuclear fuerte y difusa para FOSB, es muy útil para distinguir el hemangioma epitelioide de sus imitadores (diferentes del hemangioendotelioma pseudomiogénico, que es también positivo para FOSB). (10)
Bibliografía:
-
Wells GC, Whimster IW. Subcutaneous angiolymphoid hyperplasia with eosinophilia. Br J Dermatol. 1969;81(1):1–14. PubMed
-
Kung I.T., Gibson J.B., Bannatyne P.M. Kimura’s disease: A clinico-pathological study of 21 cases and its distinction from angiolymphoid hyperplasia with eosinophilia. Pathology. 1984;16:39–44. PubMed
-
Weiss SW, Enzinger FM. Epithelioid hemangioendothelioma: a vascular tumor often mistaken for a carcinoma. Cancer. 1982;50(5):970-81. PubMed
-
Guo R, Gavino AC. Angiolymphoid hyperplasia with eosinophilia. Arch Pathol Lab Med. 2015;139(5):683-6. Free text link
-
Calonje E., Glusac E.J., Mihm M.C., Jr., North P.E., Piris A., Requena L., Sangűeza O.P., Wick M.R. Haemangioma. In: Elder D.E., Massi D., Scolyer R.A., Willemze R., editors. WHO Classification of Skin Tumours. 4th ed. IARC Press; Lyon, France: 2018. pp. 349–350.
-
Olsen TG, Helwig EB. Angiolymphoid hyperplasia with eosinophilia: a clinicopathologic study of 116 patients. J Am Acad Dermatol. 1985;12(5, pt 1):781–796. PubMed
-
Borislav A. Epithelioid hemangioma. PathologyOutlines.com website. Accessed September 30th, 2020. Free text link
-
Papke DJ Jr, Hornick JL. What is new in endothelial neoplasia?. Virchows Arch. 2020;476(1):17-28. PubMed
-
Huang S-C, Zhang L, Sung Y-S, Chen C-L, Krausz T, Dickson BC, Kao Y-C, Agaram NP, Fletcher CDM, Antonescu CR. Frequent FOS gene rearrangements in epithelioid hemangioma: a molecular study of 58 cases with morphologic reappraisal. Am J Surg Pathol. 2015;39:1313–1321. Free text link
-
Ortins-Pina A, Llamas-Velasco M, Turpin S, Soares-de-Almeida L, Filipe P, Kutzner H. FOSB immunoreactivity in endothelia of epithelioid hemangioma (angiolymphoid hyperplasia with eosinophilia). J Cutan Pathol. 2018 Jun;45(6):395-402. PubMed

